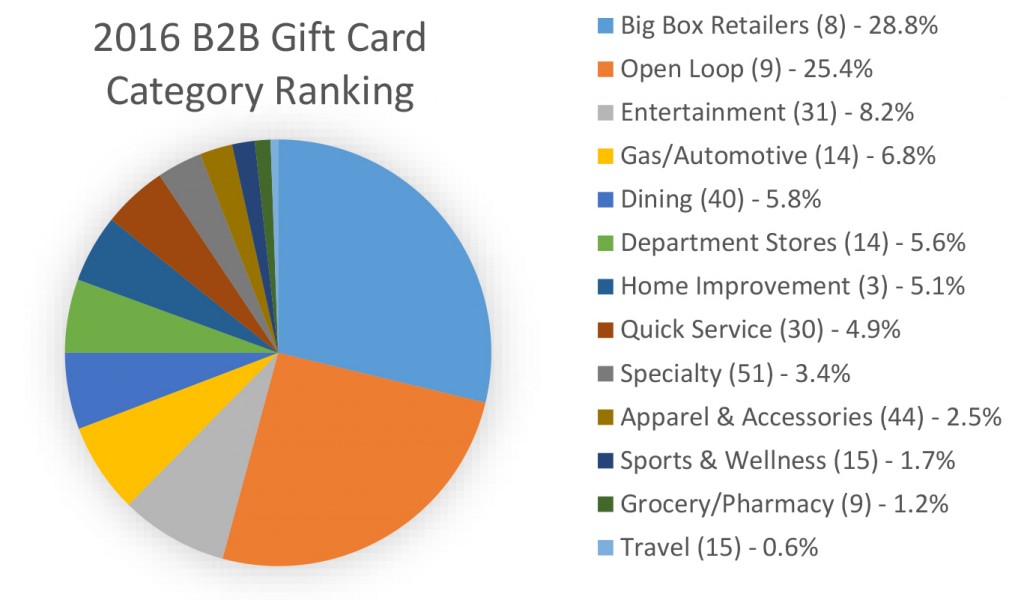
丁丹把实验室的灯都关掉。黑暗中,试管里的长余辉荧光分子,继续亮着,发出一团红色的光。
这是一种新型长余辉材料,可以用于肿瘤切除手术导航,丁丹管它叫分子影像探针。之前课题组已做过的实验显示,探针可用于精确切除小鼠腹腔转移瘤模型中的微小肿瘤。相关论文近日已刊发在《纳米通讯》上。
围绕“聚集诱导发光”(AIE)荧光分子,丁丹带领的课题组已经做了多年研究。结合生物医用高分子材料设计、制备新型分子影像探针,他们正在探索其在重大疾病诊断与治疗以及疾病发生发展机制研究方面的应用。
精巧的结合,更长时间的发光
面对恶性肿瘤,切除通常是最为常见的处理方法。不过,仅靠外科医生触诊和目视检查,也无法完全区分出恶性组织和正常组织。有时会误伤,有时又会“错放”。因此,手术刀也需要“导航系统”——荧光探针。探针在肿瘤内进行标记,肿瘤组织发出光芒,也就是发出“向我开炮”的信号,帮助实现肿瘤的精准切除。
这种荧光探针,必须有长时间的光稳定性,最好能自己发光。
丁丹是南开大学生命科学学院生物活性材料教育部重点实验室、药物化学生物学国家重点实验室教授、博士生导师。其课题组的研究方向,就是新型分子影像探针的设计、制备与生物医学应用。
团队先是瞄准了一种材料——金刚烷二氧杂化丁烷。这是一类经典的化学发光分子,能够长时间发光。但是在水相体系中,它会发生严重的信号淬灭。也就是说,一旦碰到水,其发光时间仅能维持几分钟,发光强度也很低——这不足以完成一次手术导航。
团队一直研究的,则是聚集诱导发光荧光分子(AIEgen)。它的首次发现,要追溯到2001年香港科技大学唐本忠院士团队。AIE是一类新型荧光材料,2016年《自然》杂志将AIE材料的纳米聚集体列为支撑“纳米光革命”的四大纳米材料之一。它的细胞毒性低、光学性质稳定,不怕水、亮度强,但就是在没有实时激发光的情况下不能实现长余辉发光。
能不能把两种材料的优势结合起来?课题组对AIE分子进行了设计,首次合成了一种具有AIE性质的近红外长余辉发光纳米点(AGL AIE dots)。
这是一套连锁反应——在单次外源光激发后,纳米材料中AIEgen产生的单线态氧与前体分子作用得到金刚烷-二氧杂化丁烷,后者会变得非常不稳定,发出黄光;而AIE分子恰恰是吸收黄光,发射近红外光。经化学激发和能量转移等过程,可以实现长达10天以上的自循环近红外长余辉发光。一次打光,十天照亮。
与近红外荧光材料相比,近红外长余辉发光纳米点具有更深的组织穿透能力,更高的信躁比。简而言之,它能让我们把肿瘤组织分得更清楚、看得更清晰。
除了导航,还可做体外诊断
利用AIE材料的特性,课题组还有其他创新。
丁丹介绍,他们设计出一种荧光响应过氧化亚硝酸阴离子的AIE分子,将其制备成纳米颗粒。在炎症和肿瘤组织上,都会产生过氧化亚硝酸阴离子的过表达,不过,炎症的pH值更低,肿瘤的pH值则在6.8到7.2之间。课题组制备的这种纳米颗粒,遇到过氧化亚硝酸阴离子会发光;但在酸性条件下,它又“乖巧”地不发光。这样一来,就能实现高选择性、高灵敏和实时地区分肿瘤与炎症。
以此类推,课题组可对AIE分子进行不同设计,让其在遇到需要检测的标志物时发光。这犹如给它装上一扇扇不同的门,只有输入了相应的密码,大门才会打开,透出光亮。
未来,围绕AIE分子,课题组还要做更多文章:开发富含分子内运动单元的长余辉发光有机高分子材料,将探针的设计理念拓展到长余辉发光成像。在生物医用上,可以做动脉粥样硬化等重要疾病的早期诊断,做肿瘤切除手术导航、药物筛选、干细胞示踪等。
近几年来,丁丹团队开始尝试着把技术产业化,并已经选定合作的生物科技公司,计划对检测试剂进行市场调研。团队的目标有两个方向,一个是做分子探针手术导航,一个是做体外检测。
科技日报记者 张盖伦
免责声明:本网站所有信息仅供参考,不做交易和服务的根据,如自行使用本网资料发生偏差,本站概不负责,亦不负任何法律责任。涉及到版权或其他问题,请及时联系我们。