据国务院国资委消息,4月12日,也就是全球首款新型冠状病毒灭活疫苗获国家药监局批准临床试验的当天,该疫苗Ⅰ期临床试验在河南顺利启动;临床试验第一针已在武陟县疾病预防控制中心疫苗临床研究现场完成注射。
本次临床研究为“随机、双盲、安慰剂平行对照Ⅰ/Ⅱ期临床试验”,经多项检测,32名志愿者最终入组第一阶段临床试验。
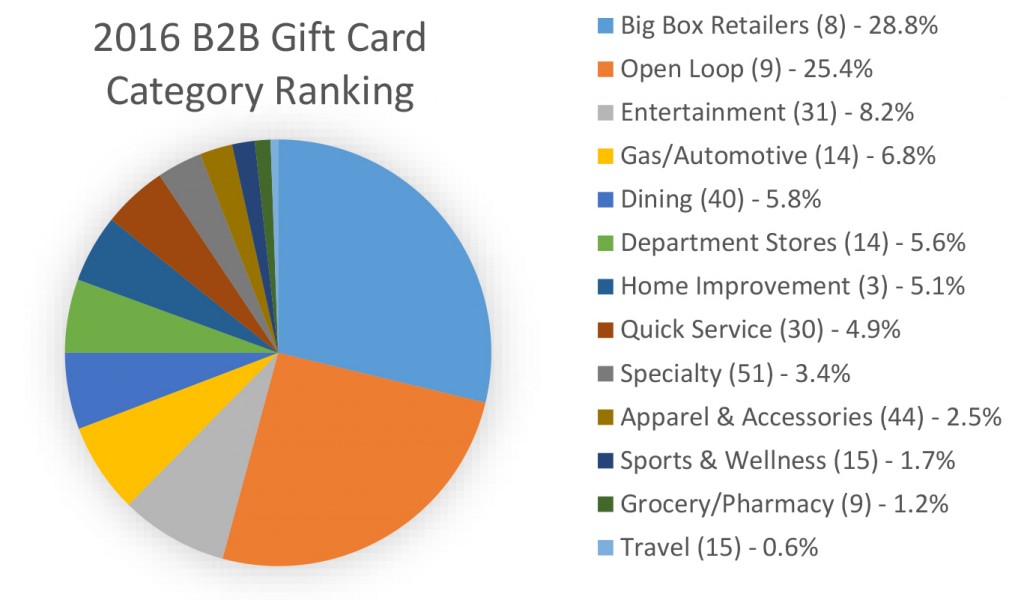
中国临床试验注册中心官网称,受试者分为Ⅰ、Ⅱ期,各期再分为低剂量组、中剂量组和高剂量组,各组均设置安慰剂对照组。Ⅰ期试验组每组24人,对照组8人;Ⅱ期试验组每组60人,对照组20人。
为什么是在河南而不是湖北进行试验?此次临床研究负责人、河南省疾控中心疫苗临床研究中心主任夏胜利表示,疫苗临床研究,“越是发病少的地区越好”,因为没有感染的地区避免了很多干扰因素,更容易验证安全性和免疫原性指标。
为什么Ⅰ/Ⅱ期临床试验合并进行?该疫苗研制方国药集团中国生物武汉生物制品研究所病毒性疫苗研究一室主任王泽鋆解释,主要是因为武汉生物所临床前研究数据较为充分,加上当前疫情防控形势依然紧张,国家药监局开通了“绿色通道”,一次性批准了两期临床试验。
至于公众关心的“如何报名参加临床试验”,河南省疾控中心方面介绍,入组后要接受严格的安全性检查,接受采血等持续性检测;而目前,线上报名渠道暂未开通,具体报名细节需咨询河南省焦作市武陟县疾控中心。
对于社会最关注的“疫苗何时上市”问题,中国疾控中心流行病学首席专家吴尊友透露,即使特事特办,完成Ⅲ期临床试验最后得出结论疫苗安全有效,最短也需要6个月的时间:Ⅰ期要做安全性试验,最短不少于20天;Ⅱ期测试疫苗接种的程序,志愿者招募完成最短需要1个月;Ⅲ期评估疫苗的有效性,最短也要3—5个月不等。
此前,中国工程院院士王军志在4月14日国务院联防联控新闻发布会上表示,Ⅰ期、Ⅱ期临床试验都是由健康志愿者参与,相对比较容易募集,根据不同的免疫程序、不同的方案,大概需要几个月的时间。真正确定疫苗的有效性是Ⅲ期临床,样本量通常需要成千上万人。而且对于一般的传染病,通常要观察一个流行周期来确定它对易感人群的保护率,而新冠肺炎目前正处于第一个流行周期中。
科技日报记者 瞿剑
免责声明:本网站所有信息仅供参考,不做交易和服务的根据,如自行使用本网资料发生偏差,本站概不负责,亦不负任何法律责任。涉及到版权或其他问题,请及时联系我们。