作者:李湛、刘亚洲(李湛为中国首席经济学家论坛理事,中山证券有限责任公司首席经济学家)
摘要
全球疫情持续爆发,新冠疫苗成为关键变量:当前距WHO确认全球新冠疫情大流行已经约6个月时间,各国的防控目标、防控策略以及执行效果均已非常明确、同时全球多数国家的现存病例均处于较高水平,再结合新冠病毒本身的传染能力,我们认为,依靠人为的疫情防控措施已经无法扼制新冠疫情的持续蔓延与爆发,预防用疫苗和治疗用药物的开发可能是影响全球疫情进展的重要变量。
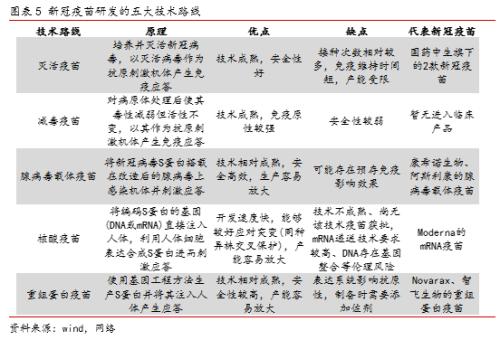
全球新冠疫苗的技术路径与研发进展:按照使用的技术路径,可将目前在研的新冠疫苗分为灭活疫苗、减毒疫苗、腺病毒载体疫苗、核酸疫苗以及重组蛋白疫苗五种类型,各类疫苗均有其优缺点。总体而言,处于临床后期的疫苗以传统的灭活疫苗、相对成熟的腺病毒载体疫苗和重组蛋白疫苗以及新颖的核酸疫苗为主,国内企业多开发成熟的灭活疫苗和腺病毒载体疫苗。
全球新冠疫苗研发如火如荼,已有约30余款新冠疫苗进入临床阶段,其中近10款疫苗已经进入临床开发后期,这些处于临床中后期阶段、且已经披露早期数据的新冠疫苗整体均呈现了较好的安全性和免疫原性特征,我们对于临床三期的结果整体持乐观态度。
总结与展望:从早期临床数据以及临床前数据来看,多支疫苗已经初步显示较好的保护效果和安全性,因此初步估计三期结果仍会比较乐观;考虑到此前FDA以及CDE出台的新冠疫苗研发指导原则对疫苗安全性和保护效力等提出的具体要求,再结合当前临床试验最新进展,我们预计国内外大概率均会有新冠疫苗在年内获批上市。同时,疫苗研发过程中必然存在的不确定性因素也可能对上市时间甚至临床结果造成较大影响。
产能与价格方面,预计年内新冠疫苗将逐步落地,尽管早期产能受限,但欧美发达国家凭借订单绑定将率先实现大规模接种,而新兴国家则将在短期面临疫苗短缺的困境;海外新冠疫苗的价格大致在6-40美元/疗程,预计国内疫苗将主要以成本加成方式定价,价格不会太高。
乐观预期下,欧美等发达经济体将凭借充裕的订单率先于20年年底-21年上半年实现大规模接种并使疫情得到逐步控制,21年产能扩大后亚太、南美等地的发展中国家也将开始大规模接种,进而使全球疫情得到较好控制;中性预期下,欧美发达国家仍将率先于20年年底-21年上半年实现大规模接种,但是疫情并不能得到充分控制,后续仍需多次接种,发展中国家同样面临类似问题,全球疫情得到控制的时间会相应滞后;悲观预期下,全球“有效新冠疫苗”供给不足,疫情将持续存在,直至疫苗或药物研发再次出现较大突破。
一、全球疫情持续爆发,疫苗成为关键变量
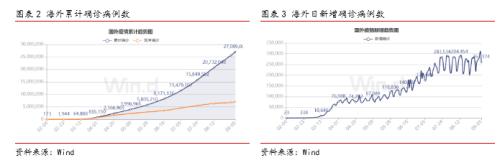
年初以来,全球新冠肺炎疫情持续爆发。截至2020年9月5日,全球新冠疫情已累计确诊超2700万人、现存病例近700万人,美国、巴西及印度等国累计确诊病例均已超400万人病例。目前全球新增确诊仍在20-30万例/天,美国、巴西、印度等主要国家疫情未见控制迹象,欧洲、南美等地多国又再次出现二次爆发,整体而言全球疫情复杂多变,长期持续。
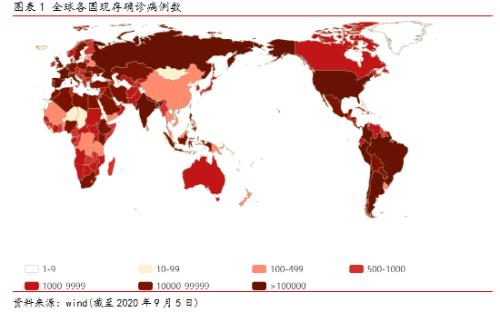
当下距WHO确认全球新冠疫情大流行已经约6个月时间,各国的防控目标、防控策略以及执行效果均已非常明确、同时全球多数国家的现存病例均处于较高水平,再结合新冠病毒本身的传染能力(综合估计新冠R0值约2-3),我们认为,依靠人为的疫情防控措施已经无法扼制新冠疫情的持续蔓延与爆发,预防用疫苗和治疗用药物的开发可能是影响全球疫情进展的重要变量。
目前来看,新冠疫苗是全球人民控制新冠疫情持续爆发、实现“群体免疫”的共同且唯一的希望。
二、全球新冠疫苗研发进展
预防用疫苗是将病原微生物及其代谢产物经过人工灭活、减毒或基因工程等技术手段处理制成的用于预防传染病的生物制品。从最早18世纪的牛痘天花疫苗,到21世纪的肺炎疫苗、HPV疫苗,目前人类已经开发了20多种预防各类疾病的疫苗,历史也多次表明,接种疫苗是人类应对传染性疾病的最有效的预防措施。也因此,新冠疫苗是现阶段全球人民控制新冠疫情持续爆发、实现“群体免疫”的共同且唯一的希望。
2.1)新冠疫苗的主要技术路径
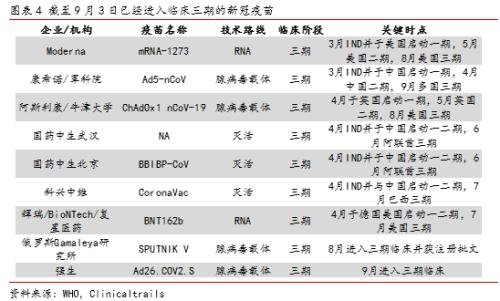
截止目前,全球新冠疫苗研发如火如荼,估计已有30余款新冠疫苗进入临床,其中近10款疫苗已经进入临床开发的后期。
按照疫苗所使用的的技术路径,可将目前在研的新冠疫苗可以分为五种类型。
1)灭活疫苗
灭活疫苗是疫苗制备中最为成熟的技术之一,其主要原理是通过培养并灭活新冠病毒、进而以灭活病毒作为抗原刺激机体产生免疫应答。
灭活技术本身相对成熟、具备较好的安全性、此前也已有多种同技术路线的疫苗成功商业化,但是灭活疫苗的主要缺点是免疫原性较弱、持续时间较短,且生产过程比较复杂。
目前在研的新冠疫苗也有多支属于灭活疫苗,其中进展最快的就是国内国药中生下属的两支灭活疫苗和国内科兴中维的灭活疫苗,前者已于6月就在阿联酋等进入三期临床试验,后者也已于7月在巴西进入三期临床试验;此外,中国医学科学院昆明所和印度Bharat Biotech的灭活疫苗目前也均处于临床阶段。
2)减毒疫苗
减毒疫苗也是疫苗制备中相对成熟的一条路线,其主要是将新冠病毒S蛋白搭载在改造后的腺病毒上感染机体并刺激应答。
尽管减毒疫苗技术成熟、较灭活疫苗也有更强的免疫原性,但是由于病毒仍存活性,安全性较弱,也因此其需要更长的研发周期以实现传代减毒和筛选过程。
目前在研的新冠疫苗中较少属于减毒疫苗路线,且尚无进入临床阶段的产品,处于临床前阶段的主要开发机构有土耳其的Acibadem集团、印度血清研究所等。
3)腺病毒载体疫苗
腺病毒载体疫苗属于载体疫苗的一种,其主要原理是将抗原基因通过无害的微生物载入人体内,诱导机体的免疫系统做出免疫应答,常用用的重要载体有:慢病毒载体、腺病毒载体以及腺相关病毒载体等。
腺病毒载体疫苗技术整体也相对成熟,疫苗本身安全高效、且相对容易放大生产,但是由于腺病毒是一种常见病毒,因此在人群中必然存在预存免疫现象、进而一定程度上影响接种免疫效果。
目前在研的新冠疫苗有不少属于腺病毒载体疫苗,其中进展最快的AZ/牛津大学以及康希诺(行情688185,诊股)生物/军科院的疫苗均为腺病毒载体疫苗、分别已于9月和8月进入三期临床,8月份已经在俄罗斯获批上市的Gamaleya研究所的产品也属于此技术路线。
4)核酸疫苗
核酸疫苗是目前最为前沿的疫苗研发技术之一,主要分为DNA疫苗和RNA疫苗,其通过将编码S蛋白的基因(DNA或mRNA)直接注入人体,利用人体细胞表达合成S蛋白进而刺激应答。
相比传统疫苗,核酸疫苗的优点在于开发速度快,制备简单,且能够较好地通过把基因改造实现同种异株交叉保护,且能够持久免疫应答。但另一方面,目前全球还没有成功商业化的核酸疫苗,因此技术的不确定性依然较大。此外,DNA疫苗还可能存在基因整合等伦理风险,RNA疫苗尽管不存在类似风险,但是其很容易被降解,所以对递送技术的要求很高,预计生产难度更大、成本也更高。
目前全球进展最快的核酸疫苗是Moderna和BioNTech的mRNA疫苗,均已经于7-8月进入三期临床试验。此外,Curevac的RNA疫苗、Inovio的DNA疫苗等多个核酸疫苗均已处于临床阶段。
5)重组蛋白疫苗
重组蛋白疫苗是将病毒的目的抗原基因构建在表达载体上,并将已构建的表达蛋白载体转化到细菌、酵母等细胞中,在一定的诱导条件下表达出抗原蛋白后纯化得到的疫苗,也是一种较为新颖的疫苗开发技术。
重组蛋白疫苗的优势在于技术相对核酸疫苗比较成熟,安全性较高,生产环境要求相比灭活病毒更低所以产能容易放大,缺点在于重组蛋白的研发对于表达系统要求加高,此外在生产过程中需要添加合适的佐剂以保证抗原的免疫性。
目前全球新冠疫苗开发中不乏重组蛋白路线,其中进展较快的有国外的Novarax、国内的智飞生物(行情300122,诊股)/中科院微生物所等,均已经进入临床二期研究。
2.2)代表疫苗品种的临床进展
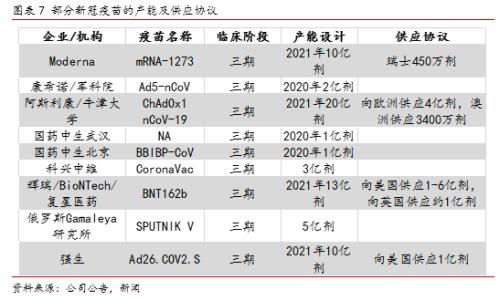
截至9月初,全球共有10支新冠疫苗进入临床三期试验(含尚未正式进入三期的Inovio的DNA疫苗以及已经获批注册使用的俄罗斯Gameleya研究所的腺病毒载体疫苗),其中进展较快的有灭活疫苗、mRNA疫苗以及腺病毒载体疫苗等。以下我们对部分处于临床后期的代表产品进行逐一解读。
1)阿斯利康/牛津大学的腺病毒载体疫苗
牛津大学与阿斯利康联合研发的ChAd0x1-S腺病毒载体疫苗是全球最早进入三期临床试验的新冠疫苗之一,其已于6月开始相继在英国、巴西、南非、日本、美国等全球多个国家进行三期临床研究。
截至9月初,该疫苗开展了两项三期研究。第一项研究始于6月11日,招募2000名18-55岁成人、1:1随机分组,研究主要终点为12个月内的新冠病毒确诊情况。2000名志愿者在接种疫苗后28天将进行中和抗体检测,并于第28天、90天、182天和364天进行随访;第二项研究始于8月17日,正在招募3万名18岁以上成人进行试验,研究主要终点为疫苗预防新冠的疗效、与安慰剂对比的安全性和耐受应等,预期该项研究将于20年12月完成主要研究,22年10月完成所有研究。
公司此前已经发表一期/二期临床的初步数据,试验表明ChAd0x1-S整体具有较好的安全性和有效性:不良反应主要为中轻度、无严重不良事件,同时疫苗能够诱导机体产生S蛋白特异抗体及抑制新冠病毒活性的中和抗体,抗体水平与恢复期患者相当,除体液免疫,疫苗也诱导发生了细胞免疫。
此外,公司表示已于欧洲多国签订疫苗,并预计将于20年Q4向FDA递交上市申请, 21年可向全球供应20亿剂。
2)Moderna的mRNA疫苗
Moderna开发的mRNA-1273是全球最早进入三期临床试验的mRNA新冠疫苗之一,其已于7月进入三期临床研究,并预计2022年10月完成全部研究。
该研究于8月17日正式启动,拟招募3万名18岁以上成人进行试验,研究主要终点为出现新冠病例、不良事件导致退出等,预期该项研究22年10月完成。
公司此前已经发表一期临床的初步数据,试验表明mRNA-1273整体具有较好的安全耐受性和免疫原性:无严重不良反应,疫苗具有较好的安全耐受性,所有受试者在首次接种15天后发生学情转化,43天后抗体水平与恢复期患者相当。
3)国药中生的灭活疫苗
国药武汉和国药北京的两款灭活疫苗是全球最先进入临床的新冠疫苗,均已于6月在阿联酋等国进行三期临床研究。
截至目前,该研究已在阿联酋招募15000名受试者,研究主要终点有接种2针后 14天的疫苗保护功效、不良事件/反应发生情况、首次接种到全面完成12个月内的血清抗体增长率及抗体水平等。
从公司此前披露的早期研究数据来看,灭活疫苗具有较好的安全性和有效性,按照0、28天程序接种2针后的中和抗体阳转率为100%。我们预计国药中生旗下的灭活疫苗有望在年内递交上市申请,但由于灭活疫苗的生产过程相对复杂,年内产能可能约2亿支左右。
4)康希诺生物/军科院的腺病毒载体疫苗
康希诺生物/军科院联合研发的Ad5-nCoV疫苗是国内最早进入三期临床试验的腺病毒载体疫苗,其已于9月开始在巴西等国进行三期临床研究,预计21年12月完成主要研究。
预计该研究将招募4万名受试者,1:1随机双盲分组,研究的主要终点为接种疫苗后12个月内的新冠肺炎发生率以及不良事件的发生率。
根据公司此前已经发表的一期/二期临床初步数据,Ad5-nCoV疫苗能够产生显著的免疫应答,不良反应发生率较低:接种14天或28天内,三级不良反应发生率约1%,且主要为自限性的发热,同时疫苗能够诱导机体产生中和抗体(但对于预存免疫的受试者而言抗体相应较弱)、80-90%的受试者均产生了T细胞相应。
总之,目前处于临床中后期阶段、已经披露早期数据的新冠疫苗整体均呈现了较好的安全性和免疫原性特征,我们对于临床三期的结果持乐观态度,但并不能从一二期数据较好而直接外推三期临床试验的保护率、安全性等符合预期,因此客观而言,疫苗研发确实仍然存在一定不确定性。
三、总结与展望
3.1)上市概率与时间节点
从早期临床数据而言,多支疫苗的临床一/二期数据已经初步显示较好的保护效果和安全性,因此初步预计三期结果仍会比较乐观;
从此前FDA以及CDE出台的新冠疫苗研发指导原则中提出的安全性和保护效力等要求来看,只要三期临床数据没有出现诸如ADE等严重不良反应事件、保护效力超过50%,则在全球疫情持续爆发背景下,国内外大概率均会有新冠疫苗获批上市。
此前上海公共卫生中心专家曾表示新冠存在ADE效应,但目前仍未有公开发表的论文、数据陈述。考虑到目前所有临床试验的疫苗均尚未出现ADE现象(高福院士近日回应),我们认为ADE效应的风险目前还只是理论层面,新冠疫苗获批依然是大概率事件。

如前文所述,目前全球研发进展最快的新冠疫苗有阿斯利康/牛津大学的腺病毒载体疫苗、辉瑞/BioNTech的mRNA疫苗、Moderna的mRNA疫苗、国内国药中生的灭活疫苗、科兴中维的灭活疫苗以及康希诺生物的腺病毒载体疫苗等。从各公司公告、相关采访等来看,预计今年四季度将会有其中多款疫苗公布初步三期临床数据、递交上市申请并获批准。
但与此同时,疫苗研发过程必然存在一定不确定性,可能会对其上市与否以及上市时间造成较大影响。近日阿斯利康的腺病毒载体疫苗因三期临床试验过程中一名受试者出现脊髓炎症疾病而暂停(现该受试者已出院),尽管数万人的临床试验出现不良事件属于正常现象,也没有证据表明该不良反应与疫苗注射有关,但目前临床试验确实被迫延期,研发进度和上市时间预期可能也会有所调整。
3.2)产能与价格
根据盖茨基金会的测算,全球至少需要100亿剂疫苗才能实现群体免疫,远超目前全球疫苗的年产能,新冠疫苗的产能则更低。
因此即使年内疫苗获批,产能仍然会是较大接种限制。我们预计年内全球总产能最多只有10亿剂级,对应保护人群仅约5亿人。考虑到核酸疫苗等技术路线的产能更容易放大,预计21年全球产能有望迅速放大至数十亿剂。
另一方面,尽管短期来看全球的疫苗产能严重不足,但是主要发达国家的储备相对更为及时充分。从美国、英国等欧美发达国家的预购情况来看,主要发达国家均已累计与疫苗企业签订1-10亿剂不等的订单,预计其订单覆盖人群占比均在50%以上;而发展中国家的产能则明显不足,目前也少有发展中国家与疫苗企业签订集中采购协议。
价格方面,根据前述AZ、辉瑞/BioNTech、强生等多个海外疫苗企业已收到的新冠疫苗预购订单,目前海外新冠疫苗价格约6-40美元不等(1-2针),其中核酸疫苗和重组蛋白疫苗价格较高,腺病毒载体疫苗价格较低。国内方面,卫健委专家等多次发言表示,预计国内疫苗将采取成本加成定价策略,我们认为,参考09年甲流疫苗约20元/针的定价,预计国内疫苗价格不会太高。
3.3)疫情防控展望
预计年底新冠疫苗逐步落地后,尽管早期产能受限,但欧美发达国家仍将凭借订单绑定率先实现大规模接种,而新兴国家则将在短期面临疫苗短缺的困境,同时全球大规模接种后的疫情防控效果还取决于疫苗的保护效力以及病毒本身的变异性等。
乐观预期下,假设1)年底开始多个临床后期疫苗陆续成功上市且保护时间足够长,2)后续病毒变异幅度不大,当前疫苗保护效力不会消失或减弱;那么按照临床方案1-2针的剂量接种后都能获得较好免疫,疫情进展仅取决于疫苗产能投放速度。预计欧美等发达经济体将凭借充裕的订单率先于20年年底-21年上半年实现大规模接种并使疫情得到逐步控制;而由于临床试验的陆续成功、核酸疫苗等新产能的快速扩大,21年年内全球总产能有望达到数十亿乃至上百亿剂,亚太、南美等地的发展中国家也将开始大规模接种,进而使全球疫情得到较好控制。
中性预期下,假设1)年底开始部分疫苗成功上市,但保护效力一般,2)病毒出现较大变异但凭借核酸疫苗的技术优势能较快应对;那么按照临床方案接种后的免疫效果相对较差,疫情进展一方面取决于产能投放,另一方面还要看后续梯队疫苗的开发速度。预计欧美发达国家仍将率先于20年年底-21年上半年实现大规模接种,但是疫情并不能得到充分控制,后续仍需多次接种;发展中国家同样面临类似问题,全球疫情得到控制的时间会相应滞后。
悲观预期下,假设新冠病毒出现很大变异但传染性和致病性却并未降低,或者部分疫苗因安全性、有效性等不及预期而无法上市,这会导致全球的“有效新冠疫苗”供给很低,全球疫情仍将持续存在,直至疫苗或药物研发再次出现较大突破才能做出比较稳妥的预测。
免责声明:本网站所有信息仅供参考,不做交易和服务的根据,如自行使用本网资料发生偏差,本站概不负责,亦不负任何法律责任。涉及到版权或其他问题,请及时联系我们。