11月12日,有自媒体发布文章,《江湖就是人情世故》,文章称,君实生物(行情688180,诊股)的研发团队是一个大专生多过博士,一大半都是本科毕业的团队,而领导这支团队和这家公司的,是一对没有任何生物学科背景的父子。
文章还指出,君实生物研发的首个国产PD-1抗体药物特瑞普利单抗注射液(拓益)在不良反应发生率为97.7%的情况下有条件批准上市,并提及特瑞普利背后君实生物与礼来制药的合作问题。
当晚,君实生物即收到上交所问询函,后者针对公众号文章内容连发四问,要求君实解答有关产品安全性、公司营收构成、与礼来制药的合作、研发人员具体构成等在内的多个问题。
11月13日早,君实生物发布澄清公告,称相关媒体文章的报道内容全面失实,并对拓益的安全数据及JS016的研发进展给予回应。公司方面表示,将保留通过法律手段追责的权利。
对于此事件中出现的争议,医药行业专业咨询机构——北京鼎臣管理咨询创始人史立臣向雷达财经表示,针对不良率、审批速度、研发团队去争论意义不大,不过拓益的"有条件上市"确实有可能对近期的医保谈判造成影响。
拇指医药认为,在当下的医药市场环境里,“进没进医保”是可以决定一家企业生死存亡的,尤其对于君实生物这样只有一个上市产品的企业来说。而本月或者下个月,国家医保局的医保准入价格谈判就要开始。君实生物无疑在最不合适的时候,受到了来自各方的密切关注,可能会影响公司的拓益的医保谈判。
雷达财经注意到,2015年至今年前三季度,君实生物合计亏损额30亿元,如果唯一一款产品拓益在医保谈判中失利,将加大公司亏损幅度。
被指研发团队大专生多过博士生,上交所四问君实生物
"老爹是个酒商,儿子是证券基金经理,但两人不仅能把一众科学家紧密地团结在周围,还能开全球先河,把默沙东、安进一众巨头甩在身后,研发能力确实强悍。"上述自媒体文章中提及。
那么在"兽爷"看来,君实生物都做了些什么呢?
公司生产的"抗癌神药"的拓益牌特瑞普利单抗注射液是国内首个获批上市的PD-1单抗药物,首个适应症为既往标准治疗失败后的局部进展或转移性黑色素瘤患者的治疗。
文章中提到,据《美国医学会杂志·内科学卷》调查数据,开发一款抗癌新药平均需要7.3年和6.5亿美元。但君实生物用不超过12亿人民币和不到一年的时间获得了PD-1临床试验的审批,并在既没有完成肝损害患者试验、也没有完成肾损害患者试验,且"所有不良反应发生率"为97.7%,有15.6%的患者因为不良反应而永久停药的情况下,"专家们考虑到临床的需求,有条件的批准了拓益的上市"。
其次是今年3月君实开始研发的新冠病毒抗体药品JS016。
文章称,这款药在临床实验没开始的情况下,被美国礼来制药报价1000万美元加7500万美元君实港股股票买走了中国区外的独家研发、生产、销售权。礼来在美国开展了两批新冠抗体临床实验,其中包含JS016的那一批连用药紧急申请都未提交就宣布停止了。但在国内,JS016从宣布开展合作研发到走向临床仅用时78天。
第三是君实生物的财务状况。"尽管年年亏损,但从2013年到2018年年底,但公司在新三板和港股市场已经融资超过了50亿元。虽然君实生物赚不到钱,但这并不妨碍他们7月中旬登陆科创板,市值一度超过1500亿。"
对以上三点,上交所问询函中均有所体现。针对特瑞普利单克隆抗体注射液(拓益),上交所要求君实生物披露"所有不良发生率"的具体含义和该产品临床实验的进展、安全性和有效性;针对JS016,君实生物需要回复与礼来制药的交易安排是否符合商业逻辑及该产品境外临床实验的具体情况。

此外,君实生物2020年1-9月营收同比大幅增长91.84%的原因、研发团队的具体构成也需公司在后续公告中披露。
君实生物全盘否认,研发人员中本科及以上学历近九成
在11月13日发布的澄清公告中,君实生物列出了拓益和同类产品在获批适应症(均为有条件批准)的安全性资料对比。
公告中从已公布的药品说明书中截取的资料显示,拓益、信达生物的信迪利单抗和恒瑞医药(行情600276,诊股)的卡瑞利珠单抗,三者"所有级别的不良反应发生率"分别为97.7%、99%和100%,三级及以上不良反应发生率为28.9%、33.3%和26.7%。
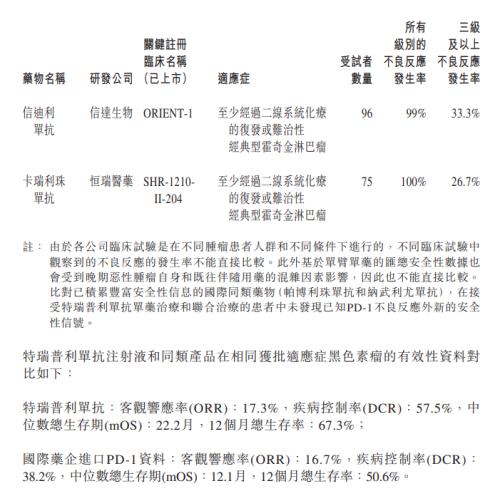
不过,君实生物也注明,由于各公司临床试验是在不同肿瘤患者人群和不同条件下进行的,不同临床试验中观察到的不良反应发生率不能直接比较。此外基于单臂单药的汇总安全性数据会受到混杂因素影响,因此也不能直接比较。
从公司列出的拓益和国际药企进口PD-1资料的对比数据来看,拓益在客观响应率、疾病控制率、中位数总生存期和12个月总生存率四个指标上均大于进口PD-1。
君实生物解释道,拓益在进行新药申请时,属于针对治疗严重疾病或降低疾病进展至更严重程度且具有未被满足临床需求的药品,符合有条件批准的相关条件。
另外,君实生物还表示,美国礼来制药停止的临床试验是一项在COVID-19患者中开展的评估评估LY-CoV555联合标准治疗(瑞德西韦)对比安慰剂联合标准治疗(瑞德西韦)的III期临床试验,不涉及JS016。
"JS016已顺利完成中国、美国2项健康受试者I期研究。国内评价JS016初步临床疗效和安全性的研究仍按原计划进行,JS016同时正在美国开展另一项由礼来制药发起的联合LY-CoV555的II期研究。"
李宁还表示,站在公司的角度,公司同礼来签署的协议处于正常进行中,总的合作方向没有变化。
对于研发团队等问题,11月14日,君实生物发布公告称,截至2020年11月12日,公司全体员工中,本科及以上学历的员工数量为1630人,占员工总人数的70.08%,其中博士45人,硕士370人。公司2017年末、2018年末、2019年末、截至2020年6月30日及截至2020年11月12日,公司研发人员数量分别为101人、159人、415人、526人及620人,占员工总人数比例分别为32.48%、26.50%、29.20%、28.05%及26.66%。研发人员数量呈显著增长趋势,目前已较2017年末增长513.86%。
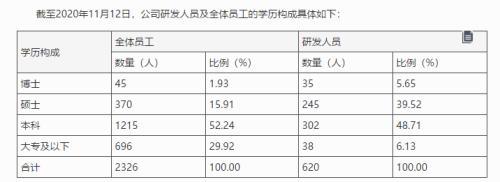
君实生物称,截至2020年11月12日,公司研发人员拥有本科及硕士学历的研发人员占研发人员总数量的88.23%,他们扎根于公司实验室、临床开发、质量管理等重要研发部门,构成了研发团队的中坚力量。博士学历的研发人员主要担任公司各研发团队的核心骨干,是公司各项研发工作中的领军人才,发挥着重要的引领作用。
雷达财经梳理发现,君实生物的控股股东与实控人熊凤祥、熊俊父子的确无生物医药背景。但君实生物CEO李宁及其高管团队大多具有海外留学及跨国药企工作背景,如公司副总经理姚盛师从"PD-1之父"华人科学家陈列平,而陈列平本人也在君实生物任职独立非执行董事职务。
五年多亏损超30亿,拓益成为营收主力
不久前,君实生物刚刚披露了2020年三季报,其中显示,公司2020年前三季度营收10.11亿元,同比增长91.78%,归母净利润亏损11.16亿元,研发费用达到12.10亿元,同比增长97.19%。
君实生物在年报中称,随着公司各项业务持续扩张和推进,短期内单产品的销售收入尚不能覆盖研发投入等费用支出,预计年初至下一报告期期末公司仍将亏损。
事实上,公司自成立以来,一直处于烧钱状态。2015年至今年前三季度,公司分别亏损0.58亿元、1.35亿元、3.17亿元、7.23亿元、7.47亿元和11.16亿元,合计亏损达30.96亿元。
目前,拓益构成了公司的营收助力。而"单产品"即为前文所述的拓益。拓益2018年获批有条件上市,并于2019年2月正式开始销售。2020年半年报显示,公司报告期内实现营收5.75亿元,同比增长85.88%,其中核心产品特瑞普利单抗的销售收入为4.26亿元,占总营收的74.09%。
营收严重依赖拓益的同时,这款"抗癌神药"本身也存在一定隐患。拓益上市时所针对的适应症为既往标准治疗失败后的局部进展或转移性黑色素瘤。有资料显示,2019年全国新发黑色素瘤病人中拓益适应症范围内的患者仅为2400人。
而国际指南中主要涉及的皮肤黑色素瘤多发于西方诸国,我国病例以肢端黑色素瘤和粘膜黑色素瘤为主。2019年,北京大学肿瘤医院教授郭军曾在美国临床肿瘤协会年会(ASCO)黑色素瘤专场上表示,对于黏膜黑色素瘤,尚看不出PD-1抑制剂较之化疗有显著优势。
从市场情况上来看,目前国内通过注册审批的PD-1单抗药物一共有六家,直接竞争对象是其它三大国产品牌:信达、恒瑞与百济神州。
信达、恒瑞的PD-1单抗分别于2019年2月和5月上市,仅从今年的半年报来看,信达通过PD-1单抗获得的销售收入分别为9.21亿元,是君实的一倍还多。
而在2019年和2020年一季度,PD-1单抗为君实生物带来的收入为7.75亿元和1.72亿元,信达生物则为10.16亿元和4亿元,恒瑞方面并没有公布卡瑞利珠单抗的单独营收,但业内估计其销售额过10亿元。
君实生物显然也意识到了这点,公司官网显示,其正为拓益申请更多适应症,包括鼻咽癌、尿路上皮癌、非小细胞肺癌、小细胞肺癌、三阴性乳腺癌、食管癌、肝细胞癌等。
专家:抓不良率意义不大,或影响拓益进医保
据拇指医药介绍,拓益销售低于信达PD-1单抗的重要原因是,2019年的医保谈判中,信达在医保谈判中报出的年费用是10.23万元,入选中标。君实因为报价10.8万元,而没有中标。
拇指医药称,君实生物在一年前和医保局价格“谈崩”,其实并不明智。因为按照规则,今后其他企业的PD-1想要进入医保,将参照目前10.23万元的年费用,只能更低,不能加高。
事后,有业内知情者说:君实当时报出的价格是10.8万元左右,这已经是他们能接受的最低价。
值得一提的是,2020年国家医保目录调整在即,除已于去年进入国家医药名单的信达生物信迪利单抗外,外企的"K药"、"O药"、君实的特瑞普利单抗、恒瑞的卡瑞珠利单抗和百济神州的替雷利珠单抗均将参与到医保谈判中。
针对与君实生物澄清公告相关的一些疑问,史立臣向雷达财经提出了自己的看法。
兽爷和君实生物的公告中,都提到了"所有不良反应发生率"指标,在史立臣看来,针对这个指标进行深究的意义不大。
"不良反应分为一到五级,一二级是轻度的,一般问题都不大,三级的时候就需要停药了,到四五级会涉及到生命危险,才不能使用。这个一定要分开来看,因为不只是抗癌药物,很多药品都有副作用,只不过有的比较轻,针对患者体质、病情不同,有的会达到三级甚至四级,但是这种几率非常小。"
史立臣认为,评估一个药,平时说的安全性、有效性其实都是泛概念,具体而言不同的节点都有很多关键的临床数据支撑。药监局的审批通过,证明其确认药品数据在合理范围内,这就说明药品的上市是没问题的。
而讨论审批速度和研发团队的学历问题也存在一定争议。
"单纯论速度的话,恒瑞的抗癌药比君实还快,其他药品还有更快上市的。学历这块,一般在研发时,领头人作为主体,研发整体的核心思路和研究关键点的把控都是由团队的核心人物来确定。关键在于做出的数据能否获得药监局评审专家组的认可,速度再快,学历再高,不经过认可就没有意义。"
"不盈利在这类企业里也比较正常,很多项目都是。一些企业做了很多年研发,但药品一直没上市,就始终在社会上融资。"
值得注意的是,史立臣还指出,君实特瑞普利单抗的"有条件上市",可能会对近期的医保谈判产生一定影响。
"关键问题在于君实PD-1是有条件上市,说明关于这款药品有很多临床数据没做完,产品还不成熟,后期需要补充去做。上市后这些需要补充、审批的关键数据是否如期如实做完了?还是正在做,做到什么程度了?"
为何一款还不成熟的药品能够成功上市呢?"因为是市场急需的产品,尤其是首次研发的产品就可能出现这种情况。上海绿谷制药治疗轻至中度阿尔茨海默症的GV-971也是有条件上市。但有条件上市和无限制使用并不能划等号,有条件上市按理说应该是有条件使用,而不是整个市场到处都卖。"
史立臣称,君实在国内的竞争对手都不是有条件上市的,这会让公司在近期的医保价格谈判中身处劣势,数据全的企业总是比不全的企业占据一定优势。
拇指医药表示,本月或者下个月,国家医保局的医保准入价格谈判就要开始。君实生物无疑在最不合适的时候,受到了来自各方的密切关注,可能会影响到公司药品拓益进入的医保谈判。
免责声明:本网站所有信息仅供参考,不做交易和服务的根据,如自行使用本网资料发生偏差,本站概不负责,亦不负任何法律责任。涉及到版权或其他问题,请及时联系我们。